SAN PABLO Y CHINA INICIAN UN CAMINO INÉDITO EN LA FABRICACIÓN DE VACUNAS, SOUTH CENTRE

El Instituto Butantan de San Pablo y el laboratorio Sinovac Life Sciences de Beijing han emprendido una experiencia inédita en América Latina durante la pandemia, al asociarse para la producción de la vacuna Coronavac, que incluye la fabricación local y la transferencia de tecnología en favor del socio brasileño.
Se espera que el Instituto butantan produzca 130 millones de dosis hasta finales de 2021, al menos 100 millones para Brasil, pero con la expectativa de exportar a la región posteriormente.
La experiencia entre Sinovac y Butantan fue analizada en un reciente seminario por Ricardo Palacios, Director de Investigación Médica, y Tiago Rocca, Gerente de Alianzas Estratégicas y Desarrollo de Negocios, del Instituto paulista.
La presentación fue moderada por Viviana Muñoz, Coordinadora del Programa Salud, Propiedad Intelectual y Biodiversidad (HIPB), de South Centre (Centro Sur), y las palabras de apertura estuvieron a cargo de Carlos Correa, Director Ejecutivo de Centro Sur.
Correa en la apertura señaló que “la fabricación de vacunas había estado dominada por unas pocas empresas, y ha habido pocos incentivos financieros para las inversiones debido a la rentabilidad limitada en comparación con otros productos farmacéuticos”.
“Sin embargo, la situación ha cambiado drásticamente con COVID-19, con una enorme demanda global que llevó a múltiples candidatos a vacunas y la competencia entre los gobiernos e incluso la instalación COVAX para comprar la producción existente”, agregó el director de South Centre.
Correa reforzó que “dada la escasez de oferta, la expansión de la capacidad de fabricación es imprescindible”, pero “la propuesta de establecer un grupo de tecnología, el Grupo de Acceso a la Tecnología COVID-19 (C-TAP), no ha dado lugar al acceso a las tecnologías necesarias y ahora está siendo sustituida por propuestas de licencias voluntarias bilaterales”.
La Coalition for Epidemic Preparedness Innovations (CEPI) mapeó 250 empresas o entidades que podrían ayudar a expandir la capacidad de fabricación de vacunas a nivel mundial, “pero hasta ahora no se han otorgado licencias voluntarias ni siquiera a las empresas de Canadá, Pakistán y Bangladesh que las solicitaron”, subrayó Correa.
Por eso, la experiencia de Butantan con Sinovac es un ejemplo importante que merece atención”, resaltó Correa.
“La fabricación actual de vacunas es insuficiente para responder a la demanda mundial y los esfuerzos a nivel multilateral para mejorar la transferencia de tecnología y la fabricación no han tenido éxito”, agregó el experto argentino en propiedad intelectual.
“Múltiples instalaciones en todo el mundo, incluso en países en desarrollo, adecuadas para la fabricación de vacunas COVID-19 actualmente no se utilizan para este propósito. Muchos podrían reutilizarse o ampliarse para producirlos, pero la renuencia de la mayoría de las empresas farmacéuticas a participar en la transferencia de tecnología pone un límite a la posible expansión de la producción”, lamentó Correa.
En este contexto, el Centro Sur ha lanzado una serie de webinars orientados a compartir información sobre las capacidades de fabricación de vacunas COVID-19 en países en desarrollo, entendiendo cómo se construyen y podrían expandirse, facilitando el intercambio de experiencias concretas en el abordaje de temas de transferencia de tecnología, conocimientos técnicos y propiedad intelectual en acuerdos contractuales, y el avance de ideas sobre cómo abordar los múltiples desafíos que surgen, resaltó la organización.
En ese contexto fue que Correa resaltó la experiencia positiva de la asociación entre Sinovac y el Instituto Butantan, uno de los principales institutos de salud pública de Brasil y el mayor productor de inmunobiológicos y biofarmacéuticos de América Latina, con una vasta experiencia en enfermedades tropicales, que ha logrado aunar las dimensiones de la manufactura industrial y la salud pública.
Las necesidades convergentes de ambas partes (Sinovac necesitaba un socio para los ensayos clínicos fuera de China , donde los casos de COVID-19 no estaban lo suficientemente extendidos, mientras que Brasil necesitaba acceso a vacunas), el panorama regulatorio en Brasil, las capacidades científicas e industriales para la absorción de tecnología, la disponibilidad de apoyo financiero para las inversiones requeridas, fueron algunos de los factores que permitió que la asociación se materializara, se subrayó durante el seminario.
Tiago Rocca, Gerente de Alianzas Estratégicas y Desarrollo de Negocios del Instituto Butantan, señaló con 120 años de historia, el laboratorio paulista tiene capacidad para pruebas, cadenas de frío, capacidades industriales más amplias para absorber tecnología y experiencia con la producción de vacunas.
Cuando llegó el COVID-19, Butantan realizó una prospección de posibles socios y Rocca señaló que los productores de vacunas tuvieron diferentes reacciones al ser contactados por Butantan: “algunos no querían realizar transferencia de tecnología, algunos solo querían vender productos en Brasil. La colaboración más adecuada fue con Sinovac, que necesitaba un socio para realizar ensayos clínicos fuera de China -como se reportaron pocos casos allí- y estaba dispuesto a colaborar más profundamente con Butantan”.
Rocca también destacó que la asociación de Butantan con Sinovac incluye la transferencia analítica, un elemento de transferencia de tecnología al que se hace referencia con menos frecuencia.
Por el momento, en Butantan se llena y completa el envasado para las vacunas que vienen de China, pero espera producir completamente localmente en el futuro. Se está construyendo una nueva planta de fabricación de nivel 3 de bioseguridad que permitirá la fabricación completa en Brasil para septiembre de 2021, sobre la base de las instalaciones existentes.
En sus comentarios, Ricardo Palacios, Director de Investigación Médica del Instituto Butantan, señaló que Sinovac, a diferencia de las compañías farmacéuticas más grandes como Merck o Sanofi, no podía realizar ensayos clínicos por sí sola, lo que favorecía la asociación.
“Para los países que negocian solo los ensayos sin las capacidades industriales, el riesgo es que los ciudadanos del país ayuden a probar la seguridad y eficacia de las vacunas sin recibirlas realmente”, alertó Palacios.
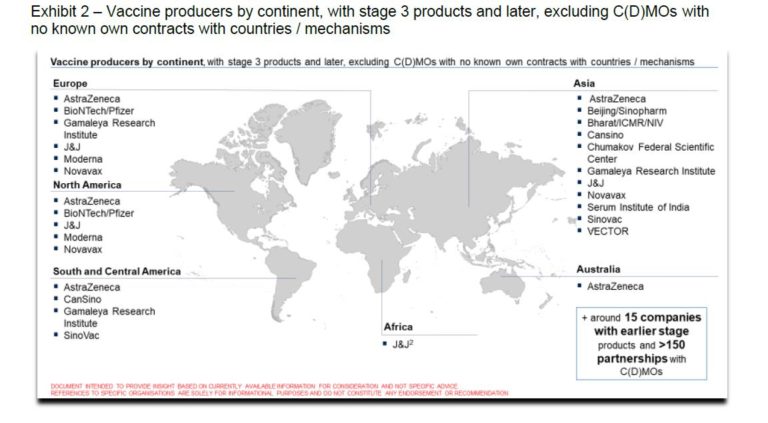
El directivo afirmó que unir los lados clínico e industrial permitió una colaboración más profunda de Butantan con Sinovac.
Por eso, sugirió que no se debería dejar a los investigadores locales negociando con el fabricante de la vacuna sin el apoyo del gobierno y sin capacidades industriales locales.
Palacios también defendió seguir avanzando en el trabajo con tecnologías más antiguas, mientras se adoptan o desarrollan tecnologías más nuevas. Recordó que CEPI y COVAX financiaron tecnologías de vacunas en gran parte más nuevas y tenían la tendencia a ignorar las tecnologías más antiguas, como los virus inactivados (caso de la vacuna de Sinovac), que son efectivos, cuestan menos y pueden producirse de manera más amplia y oportuna, especialmente en los países en desarrollo.
“Tanto las tecnologías nuevas como las antiguas son importantes, sin embargo, una mayor atención a las tecnologías existentes habría sido útil para acelerar la ampliación de la vacuna. El apoyo internacional de donantes como PATH también ha sido fundamental para Butantan y Sinovac. Por último, el fortalecimiento de los interlocutores locales es fundamental para el éxito de las asociaciones”, completó.
En preguntas y respuestas, Rocca reiteró que la colaboración entre Butantan y el Ministerio de Salud de Brasil ha sido técnica y fluida durante décadas.
También destacó la importancia de un ecosistema de apoyo más amplio (productores, laboratorios, universidades), y que existen algunas brechas tecnológicas que dificultan la construcción de otras colaboraciones.
“Por ejemplo, no hay conocimientos técnicos para las vacunas de ARNm y esto sería mucho más difícil de implementar. Ésta es un área que requiere inversiones con un enfoque con visión de futuro. Por el momento, es necesario establecer prioridades y no se puede detener la producción de otras vacunas debido a la nueva demanda de vacunas COVID-19”, afirmó.
Palacios también respondió a preguntas sobre las razones por las cuales otras empresas no se habían comprometido con Butantan. Estas incluyen el interés por mantener el codesarrollo de la vacuna bajo el control de la empresa, las estrategias de mercado y territorio, y la adecuación no técnica con las capacidades existentes para la transferencia de tecnología.
La fecha del próximo seminario web de la serie South Centre sobre capacidad de fabricación en países en desarrollo se anunciará en el sitio web "Un enfoque de salud pública para los derechos de propiedad intelectual" del South Centre, https://ipaccessmeds.southcentre.int/
[1] Ver nota conceptual, información adicional y grabación completa del evento en el siguiente enlace: https://ipaccessmeds.southcentre.int/event/man manufacturing-capacity-for-covid-19-vaccines-the-experience-of- butantan-sinovac/
